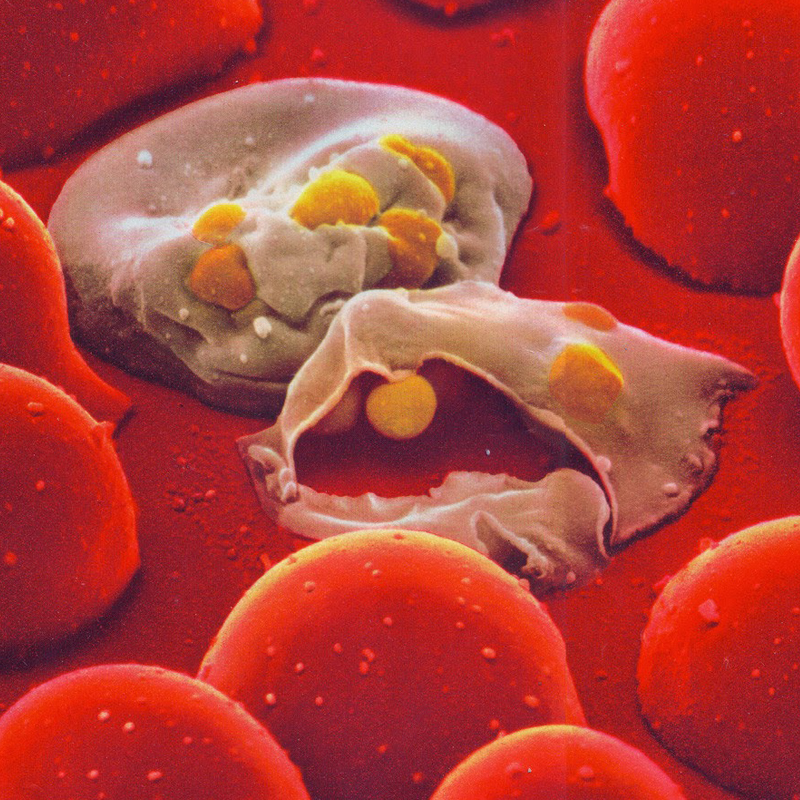
Um tipo de linfócito pouco estudado mata a célula infectada com parasitas por fagocitose ou injetando toxinas
O protozoário Plasmodium falciparum, parasita unicelular que causa a forma mais letal de malária, e mais comum na África, consegue driblar o sistema imune alojando-se dentro das hemácias, um tipo de célula do sangue que não consegue sinalizar para o sistema de defesa que está infectada. Um estudo publicado na revista Nature Immunology sugere que um tipo de linfócito T pouco estudado, conhecido como γδ (gama delta), é capaz de fagocitar o P. falciparum ‒ o equivalente, para uma célula, a engolir e digerir o parasita ‒ junto com a própria hemácia.
“Essa foi a primeira vez que observamos a fagocitose por linfócitos de hemácias infectadas”, revela a imunologista Caroline Junqueira, do Instituto René Rachou, parte da Fundação Oswaldo Cruz (Fiocruz) em Minas Gerais. “A observação se deu por acaso e foi uma grande surpresa.” A fagocitose foi flagrada em placas de laboratório com amostras de sangue retiradas de pacientes de Rondônia.
Depois, Junqueira verificou que as hemácias fagocitadas estavam cobertas por anticorpos produzidos pelos pacientes como resultado da infecção. “Os anticorpos estimulam a fagocitose, como se tornassem a célula mais apetitosa”, observa o parasitologista Marcelo Urbano Ferreira, do Instituto de Ciências Biomédicas (ICB) da USP, que não participou do estudo. Os pesquisadores demonstraram que a fagocitose se dá pela ligação entre as células de defesa e a cadeia constante dos anticorpos (sua parte mais estável). Ao bloquear os receptores do tipo CD16 dos linfócitos, normalmente responsáveis pela comunicação entre essas células e os anticorpos, eles interromperam a fagocitose.
A fagocitose surpreendeu porque geralmente não é feita por linfócitos, que são considerados parte do sistema imune adquirido ‒ aquele que se desenvolve ao longo da vida e muda conforme a pessoa entra em contato com patógenos ou antígenos presentes em vacinas. A fagocitose é comum em células como os macrófagos, parte do sistema imune que já vem pronto quando uma pessoa nasce.
“A resposta inata começa bem no início da infecção e depois o organismo desenvolve a adquirida, que é mais eficiente”, explica o imunologista Ricardo Gazzinelli, da unidade da Fiocruz na Faculdade de Medicina de Ribeirão Preto da Universidade de São Paulo (FMRP-USP). O comportamento dos linfócitos T γδ faz com que eles sejam considerados células imunes intermediárias entre o sistema imune inato e o adquirido.
Alternativa tóxica
Mas no organismo a fagocitose não acontece tão facilmente quanto nos experimentos in vitro. Quando não há anticorpos presentes, o linfócito T γδ usa outra estratégia e faz algo de que nenhum outro linfócito T é capaz: detecta hemácias infectadas com P. falciparum e injeta toxina que destrói o parasita e a célula. Isso pode acontecer mesmo na ausência do Complexo Principal de Histocompatibilidade (MHC), uma molécula que, alojada na membrana celular, serve como uma janela reveladora de patógenos invasores.
Todos os linfócitos, com exceção do T γδ, se apoiam no MHC para localizar alvos dentro da célula do hospedeiro. “Mas o linfócito T γδ usa outra proteína, chamada butirofilina, para se conectar à célula infectada”, ressalta Junqueira. No interior da célula, o próprio parasita ativa a butirofilina por meio de uma substância que faz parte do seu metabolismo.
A butirofilina ativada, por sua vez, promove a multiplicação dos linfócitos T γδ, o que, em tese, reforçaria o sistema imune contra o P. falciparum. Mas a resposta não é suficiente para eliminar o parasita porque não ativa o sistema imune adquirido – mais eficiente do que o inato e capaz de guardar memória da infecção, propriedade importante nas vacinas.
“O estudo revela novos detalhes do mecanismo que os linfócitos T γδ usam para eliminar hemácias parasitadas”, observa Ferreira. “Já a fagocitose é uma observação totalmente nova.” Ele ressalta que o trabalho apresenta as limitações normais de um estudo in vitro ‒ por exemplo, o fato de que as células do sangue podem se comportar de formas diferentes nos órgãos linfoides ‒ e que será necessário confirmar os achados em modelo animal.
Novas vacinas
Os pesquisadores inferem que o fosfoantígeno, substância que ativa a butirofilina, pode funcionar como adjuvante de vacina, ajudando o antígeno presente no imunizante a provocar uma resposta imunológica mais rápida, eficaz e duradoura. Isso poderia melhorar a única vacina aprovada contra a malária causada pelo P. falciparum. Além de ter baixa eficácia, ela exige a aplicação de quatro doses.
A equipe da Fiocruz já está desenvolvendo uma vacina contra outro tipo de protozoário, o P. vivax, mais comum no Brasil e que causa um tipo de malária mais branda. Eles observaram que o P. vivax só infecta as células que dão origem às hemácias. São os reticulócitos, que expressam moléculas de MHC em sua superfície, conforme relatado em estudo publicado pelo mesmo grupo em 2018 na revista Nature Medicine.
Isso abre caminho para desenvolver uma vacina tradicional contra P. vivax capaz de aumentar o número de anticorpos estimulando os linfócitos T e B, que guardam memória da resposta imune. “Estamos tentando identificar um antígeno do parasita que ative o MHC do reticulócito, que, por sua vez, estimula os linfócitos”, diz Junqueira.
“O objetivo de toda vacina é ativar o sistema imune, especialmente o adquirido, que já tem as ferramentas necessárias mas demora a funcionar de forma eficaz”, esclarece Gazzinelli. Para contornar essa limitação, a maioria das vacinas simula uma infecção, estimulando os linfócitos T e B não só a combater o parasita, mas a guardar a memória imunológica caso uma nova infecção aconteça.
Projeto
Mecanismos imunológicos de resistência e patogênese da malária (nº 16/23618-8USP )
Conheça os outros artigos do BlogCiência RuraltecTV clicando no LINK.